03.09.2022
| Dr. Klaus Reithmayer
Der pH-Wert ist eine der wichtigsten und am häufigsten gemessenen Größen in der analytischen Chemie. Ein pH-Messgerät wird immer dann benötigt, wenn der pH-Messwert exakt bestimmt werden muss. Ein entsprechendes pH-Meter steht in praktisch jedem Labor zur Verfügung.
In diesem Beitrag finden Sie Antworten auf diese Fragen und Themen rund um die pH-Messung:
- Welche Werte kann der pH-Wert annehmen?
- Welche Bedeutung hat der pH-Wert?
- Wie wird der pH-Wert gemessen?
- Der Aufbau einer pH-Elektrode
- Doch wie sieht die pH-Elektrode nun aus?
- Das pH-Messgerät oder pH-Meter
Der pH-Wert ist nach Sörensen der negative dekadische Logarithmus der Aktivität der Wasserstoffionen:
pH= -log aH+
Das ist eine etwas sperrige Definition, aber die folgenden Zeilen werden etwas Licht in die Angelegenheit bringen. Der pH-Wert ist eine essenzielle Grundlage für eine Fülle von Reaktionen in allen wasserbasierten Medien und wesentlich für uns als lebendige Wesen, aber auch in unzähligen natürlichen und technischen Zusammenhängen.
Der Begriff der Aktivität lässt sich am leichtesten mit effektiver Konzentration umschreiben. Das kann man sich mit folgendem Bild vorstellen:
Wenn jemand versucht durch eine dichte Menschenmenge zu laufen, um ein bestimmtes Ziel zu erreichen, wird er vermutlich nur schwer durchkommen. Er wird ständig gebremst und muss immer wieder die Richtung ändern.
Genauso verhält es sich mit Ionen in einer hochkonzentrierten Lösung. Auch sie interagieren mit anderen Ionen und die Reaktion läuft langsamer ab. Sind hingegen nur wenige Menschen auf der Straße, kommt der Läufer schnell durch und erreicht sein Ziel. Das Gleiche gilt für Ionen in einer verdünnten Lösung. Damit steigt die Aktivität und es erklärt sich leicht, warum man hier statt der Konzentration die Aktivität zur Beschreibung wählt: sie gibt an, was tatsächlich gemessen werden kann.
Tipp: Ein kleiner Hinweis an dieser Stelle: bei stark verdünnten Lösungen können wir der Einfachheit halber immer davon ausgehen, dass Konzentration und Aktivität gleichzusetzen sind.
Welche Werte kann der pH-Wert annehmen?
Oben wurde bereits angedeutet, dass der pH-Wert mit Wasser zu tun hat. Und tatsächlich ist es so, dass Wasser zu einem kleinen Teil in H+ -Ionen und OH- -Ionen zerfällt.
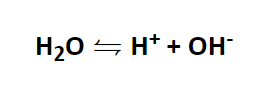
Bei genau 25 °C ist betrögt das sogenannte Ionenprodukt:
[H+] * [OH-] = 10-14
Es folgt aus den beiden Gleichungen, dass die Aktivität für H+ und OH- gleich ist und für beide Ionen jeweils 10-7 mol/l entspricht.
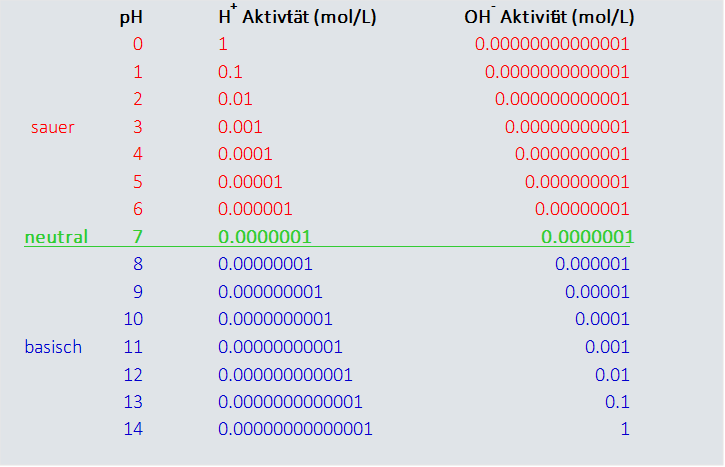
Abb 1:Aufbau einer pH-Skala zur Bestimmung des pH-Wertes.
Alle pH-Werte die kleiner sind als 7, zeigen eine erhöhte Aktivität des Wasserstoffions und sind somit sauer. Bei sinkender Aktivität des Wasserstoffions (Protons) steigt die Aktivität des Hydroxids der pH-Wert wird größer als 7 und die Lösung wird basisch. Technisch sind pH-Werte größer 14 und kleiner 0 möglich, bereiten aber messtechnisch große Schwierigkeiten.
Welche Bedeutung hat der pH-Wert?
Der pH-Wert hat, wie oben schon angedeutet, eine umfassende Bedeutung in wässrigen Lösungen und wasserhaltigen Produkten. Er beeinflusst chemische und biochemische Reaktionen, ist verantwortlich für Produkteigenschaften, effiziente Darstellung von Chemieprodukten und physiologischen Vorgängen.
Wichtige Bedarfe unseres täglichen Lebens werden vom pH-Wert grundlegend beeinflusst, zum Beispiel gibt es dezidierte Vorschriften über den pH-Bereich, den unser Trinkwasser hat. Der pH-Wert beeinflusst Farbe, Geschmack und Haltbarkeit unserer Lebensmittel. Er wird aber auch gemessen, um Schäden an Technik und Natur zu vermeiden und ggfs. Gegenmaßnahmen einleiten zu können.
Die untenstehende Graphik gibt ein Verständnis, wo der pH-Wert uns in unserem Alltag begegnet:
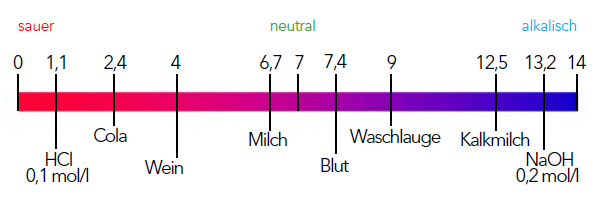
Abb 2: Bedeutung des pH-Wertes im Alltag.
Wie wird der pH-Wert gemessen?
Eines der wichtigsten Organe für uns Menschen, das den pH-Wert tagtäglich „misst“, ist unsere Zunge. Dieser wichtige Sinn hat für uns entscheidende Bedeutung, da viele Lebensmittel schwach sauer sind und damit Genießbarkeit und Frische suggerieren. Faulige oder ungenießbare Dinge kommen oft mit einem seifigen Geschmack einher, der als widerlich empfunden wird und den Verzehr vermeidet.
Der Nachteil am physiologischen Geschmacksempfinden ist, dass der pH-Wert nicht quantifiziert werden kann. Ein Beispiel sind Cola-Getränke, wo Zucker oder Süßstoff den pH-Wert von ca. 2,5 bis 2,8 pH einfach überdecken. Ohne diesen Zusatz bewegen wir uns im Bereich von purem Haushaltsessig, den freiwillig keiner zur Erfrischung trinkt.
Es gibt viele Möglichkeiten, den pH-Wert zu messen. Es werden Indikatorpapiere oder Farblösungen angeboten, die in Abhängigkeit vom pH-Wert ihre Farbe ändern.
Der Nachteil ist:
- dass die Farbreaktionen unterschiedlich wahrgenommen werden können
- das Umschlagraster zu grob ist
- sie für eine kontinuierliche Messung zum Beispiel beim Einbau in eine Rohrleitung nicht geeignet sind.
Zudem kann die Probe wie zum Beispiel Wandfarbe das Ablesen unmöglich machen.
Die wichtigste Möglichkeit pH-Wert quantitativ korrekt zu erfassen ist derzeit die Messung mit der pH-Elektrode und einem entsprechenden Auswertegerät, dem pH-Messgerät oder auch bekannt als pH-Meter.
ph-Fibel - Ein Ratgeber für die Praxis der pH-Messung
 In unserer pH-Fibel finden Sie unser gesamtes Expertenwissen zum Thema pH/Redox. Auf 100 Seiten erfahren Sie sehr anschaulich Praxiswissen rund um die pH-Messung und die pH-Bestimmung. Zahlreiche Abbildungen, Tabellen und Diagramme sorgen für eine anschauliche Wissensvermittlung, wie Sie den pH-Wert richtig messen, die pH-Elektrode kalibrieren, pflegen, reinigen und viele weitere hilfreiche Tipps und Tricks unserer Experten die Ihren Arbeitsalltag im Labor und auf dem Feld erleichtern. Laden Sie sich hier die pH-Fibel als PDF herunter:
In unserer pH-Fibel finden Sie unser gesamtes Expertenwissen zum Thema pH/Redox. Auf 100 Seiten erfahren Sie sehr anschaulich Praxiswissen rund um die pH-Messung und die pH-Bestimmung. Zahlreiche Abbildungen, Tabellen und Diagramme sorgen für eine anschauliche Wissensvermittlung, wie Sie den pH-Wert richtig messen, die pH-Elektrode kalibrieren, pflegen, reinigen und viele weitere hilfreiche Tipps und Tricks unserer Experten die Ihren Arbeitsalltag im Labor und auf dem Feld erleichtern. Laden Sie sich hier die pH-Fibel als PDF herunter:
Jetzt pH Fibel herunterladen
Der Aufbau einer pH-Elektrode
Eine pH-Elektrode ist ein elektrochemischer Sensor und beruht auf der Potentiometrie, also der Messung einer Spannung. Diese Spannung wird über die sogenannte Nernst-Gleichung beschrieben, deren Ableitung in allen Standardwerken der Physikalischen Chemie ausführlich beschreiben wird.
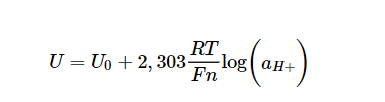
U: Potential der pH-Elektrode
U0: Asymmetriepotential (z.B. bei pH 7)
2,303: Umrechnungsfaktor natürlich/dekadischer Logarithmus
R: Allgemeine Gaskonstante 8,3145 V As/(mol K)
T: absolute Temperatur in K
F: Faraday-Konstante 9,648*104 As/mol
n: Ladung des beteiligten Ions (H+, n=1)
log: dekadischer Logarithmus
a: Aktivität (a = f * c), f: Aktivitätskoeffizient (0 < f ≤ 1)
Im Prinzip handelt es sich beim pH-Signal also um ein Spannungssignal, hervorgerufen durch die Aktivität der Wasserstoffionen, gemessen in mV. Die obige Gleichung ist bei genauer Betrachtung eine Geradengleichung mit Achsenabschnitt (=Asymmetrie oder Nullpunkt) und Steigung. Setzt man die obigen Werte in den Steigungsterm ein, ergibt sich eine Steigung von 59,2 mV/pH bei 298 K (= 25 °C).
Doch wie sieht die pH-Elektrode nun aus?
Die pH-Elektrode (oft auch als Glas-Elektrode bezeichnet) besteht aus zwei Komponenten:
- Der pH-empfindliche Teil, die sogenannte Glas-Elektrode, der Namensgeber mit seinem pH-empfindlichen Spezialglas und
- der sogenannten Referenzelektrode, heute fast ausschließlich ein in eine Matrix eingebettetes Silber/Silberchloridelement, die ein weitgehend konstantes Potential liefert, gegen das das sich verändernde Potential der Glaselektrode gemessen wird.
Um es vorwegzunehmen, auch im Inneren der Glaselektrode befindet sich ein Referenzelement, die sogenannte Innere Referenz, die das Signal der Glasmembran aufnimmt. Das elektrische Spannungssignal wird am Anschlusskopf abgenommen und zum Messgerät geleitet.
Die folgende Illustration zeigt den schematischen Aufbau im Vergleich zu einer handelsüblichen pH-Elektrode.
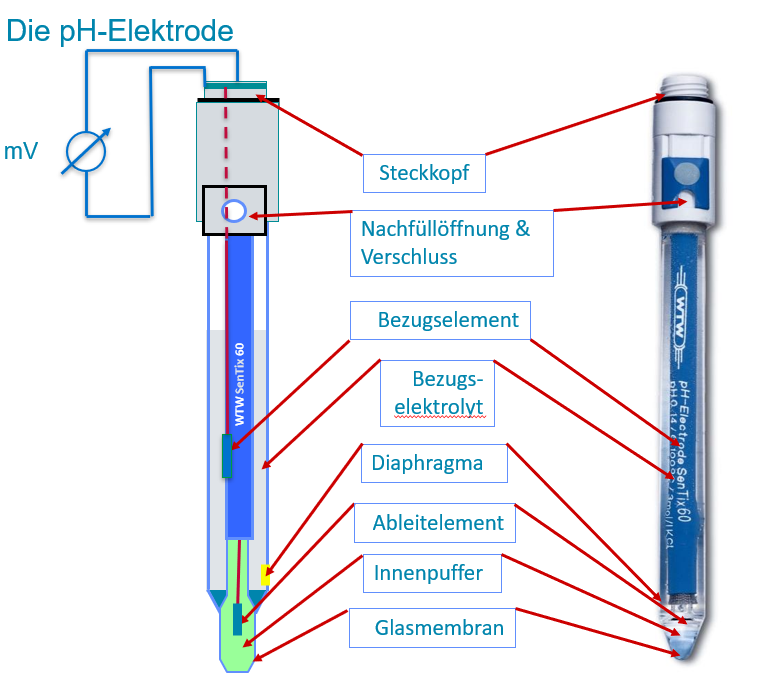
Abb 3: Schematischer Aufbau einer pH-Elektrode im Vergleich zu einer handelsüblichen pH-Elektrode.
Passende pH-Elektroden für Labor und Feld finden Sie hier!
Das pH-Messgerät oder pH-Meter
Ein pH-Messgerät ist eigentlich ein hochohmiges Spannungsmessgerät. Es gibt sie je nach Anwendung als Laborgeräte oder in tragbarer Form für den mobilen Einsatz und für die Messung in Prozessen auch als stationäre pH-Messgeräte.

Abb 4: pH-Messgerät inoLab® pH 7110 für einfache Routinemessung mit pH-Elektrode SenTix® 81.

Abb 5: Tragbares pH-Meter ProfiLine pH 3310 mit SenTix® 41.

Abb 6: Digitale IDS pH-Elektrode SenTix® 980.
Beide besitzen einen Messverstärker mit einem Eingangswiderstand von > 0,5 + 1012 Ohm, um das empfindliche Messsignal korrekt zu erfassen. Handelsübliche Voltmeter sind dazu nicht in der Lage.
Passende pH-Messgeräte für Ihre Anwendungen können Sie hier entdecken - für Ihren Einsatz im Labor oder für die mobile pH-Messung unterwegs.
Weitere Fragen werden im Blogartikel FAQ pH-Messung von unserem Experten beantwortet. Hilfreiche Tipps für Ihren Anwendungsbereich, können Sie in unseren Blogartikeln nachlesen:
 pH-Elektroden Auswahltool
pH-Elektroden Auswahltool
Sie fragen sich, ob die von Ihnen gewählte pH-Elektrode die richtige ist?
Beantworten Sie in unserem neuen Tool einfach 5 Fragen und Sie erhalten die passende pH-Elektrode für Ihre Anwendung.
Jetzt ausprobieren!